|
|
30 | |||||||
| 20 | ||||||||
| Horácovo akvárium | 60 | |||||||
|
aneb historie a současnost všelikého mého pinožení se v akvaristice |
20 | |||||||
| | MAPA STRÁNEK | O WEBU | HOME | | 30 | |||||||
| 20 | ||||||||
|
© 2004-3004 Jiří Horáček |
30 | |||||||
|
30 |
||||||||
|
| ÚVOD | MOJE AKVÁRKA | LITERATURA | ODKAZY | ČLÁNKY | ATLASY | PORADNA | KNIHA NÁVŠTĚV | RŮZNÉ | NOVINKY | |
||||||||
| 24 | 40 | 40 | 546 | 114 | 232 | 40 | 40 | 24 |
|
Akvárium a chemie : nepochopený graf |
||
|
poprvé publikováno : 31.1.2016 [ zpět na přehled článků ] |
||
| 24 | 1052/20 | 24 |
| 24 | 1052/20 | 24 |
|
■ obsah |
||
|
úvod - varování - několik základních pojmů
- graf uhličitanové rovnováhy - co
všechno se z něho dá vyčíst -
|
||
|
■ úvod |
||
|
_____K napsání tohoto článku mě někdy v roce 2013 inspirovala jistá diskuse na webu rybicky.net. ... Sednul jsem ke kompu, začal psát ... ale nedotáhl jsem to do konce. (Na téma prokrastinace bych mohl napsat minimálně tisícistránkovou knihu :-). Jenže já bych začal ... :-))) ... Nebudu zdržovat : nedávno jsem dostal chuť "dorazit" ho :) ... tak jsem to udělal :-) ... _____Poznámka: Článek se měl původně jmenovat NEPOCHOPENÝ GRAF aneb TAKHLE TO V AKVÁRKU NEFUNGUJE, ale přišlo mi to moc dlouhý ... (já jen, abych naznačil, o čem to vlastně bude :-) ... _____Tento článek ani zdaleka nevyčerpává celé téma "CO2 v akváriu". Další informace najdete v jiném článku. (snad) (jednou) ... |
||
|
■ varování |
||
| _____Následující text obsahuje chemické pojmy, vzorce a reakce. Máte-li s tím problém, nečtěte to. Akvaristika se dá dělat i bez toho. | ||
|
■ omluva |
||
| _____V článku se vyskytují odkazy na dosud nedokončené články ... takže jsou nefunkční. Vydržte. | ||
|
■ několik základních pojmů |
| 24 | 60 | 60 | 100+10 | 24 | 10+90+10 | 24 | 10+105+10 | 24 | 10+110+10 | 260 | 125 | 24 | |||||||
|
_____(Anorganický) uhlík je ve vodě přítomen v těchto čtyřech formách: jako oxid uhličitý CO2, kyselina uhličitá H2CO3 a její soli - hydrogenuhličitany HCO3- a uhličitany CO32-. Suma všech těchto sloučenin tvoří v akváriu tzv. celkový anorganický uhlík. _____Při rozpouštění CO2 ve vodě vzniká tzv. uhličitanový systém, který charakterizuje tato kaskáda chemických rovnic : CO2 + H2O ↔ ( H2CO3 ) ↔ H+ + HCO3- ↔ 2H+ + CO32- [ Ca2+ + CO32- → CaCO3 (s) ] (vysrážení uhličitanu) (pK jednotlivých rovnováh : pK0 = 1,47, pK1 = 6,35 a pK2 = 10,33) |
80 | ||||||||||||||||||
_____Uhličitanový systém je nejvýznamnější protolytický systém přírodních vod. Ovlivňuje pH, neutralizační a tlumivou kapacitu, agresivitu a inkrustační účinky vody. Od ostatních pufračních systémů se liší zejména tím, že je otevřený - dochází k výměně CO2 mezi kapalnou a plynnou fází.
_____oxid uhličitý CO2 : molekulární CO2.
Plyn, velmi dobře rozpustný ve vodě. Jednotlivé složky uhličitanového
systému lze považovat za formy oxidu
uhličitého. Potom rozlišujeme oxid uhličitý volný (CO2
a H2CO3)
a vázaný (obsažený v HCO3- a
CO32-). Jejich součet se pak nazývá
veškerý oxid uhličitý. |
||
|
■ graf uhličitanové rovnováhy |
||
|
_____Přesněji distribuční diagram uhličitanového systému, vyjadřuje závislost procentuálního zastoupení jednotlivých složek uhličitanového systému na pH. Je grafickým vyjádřením Henderson-Hasselbalchovy rovnice (HHR). |
||
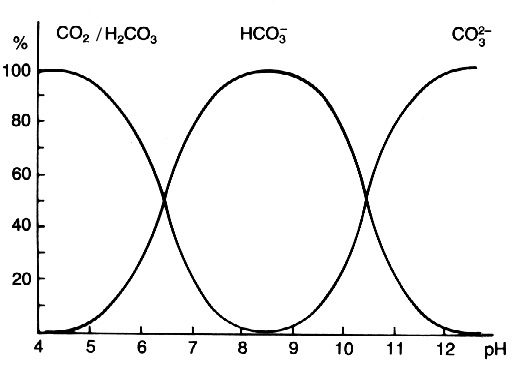 |
||||
| 24 | 275 | 502/20 | 275 | 24 |
|
to je on ... (téměř notoricky známý) graf uhličitanové rovnováhy ... popisující ... uhličitanovou rovnováhu :-) |
||||
| 24 | 1052/20 | 24 |
|
■ co všechno se z něho dá vyčíst : |
||
|
_____1) procentuální
zastoupení CO2/H2CO3, HCO3-
a CO32- se mění s pH (ale o tom zde už
dobrou čtvrthodinu hovoříme, Mlho :-) ... |
||
|
■ co se z něho vyčíst nedá (resp. dá, ale mnoha lidem to nedochází) : |
||
|
_____Tento graf popisuje chování ideálního, hermeticky uzavřeného systému, ze kterého nemůže nic utéct (ano, tušíte správně, řeč je o CO2 :-) ... Jinými slovy, abychom se mohli libovolně pohybovat po ose x (pH), ať už doprava (přikapávání louhu) nebo doleva (přikapávání kyseliny), ... pokud máme pokaždé, když se vrátíme na stejné pH, dostat také stejné hodnoty na ose y .... musí celkový anorganický uhlík zůstavat konstantní. Jenomže ... _____1) akvárium není hermeticky uzavřený systém (ne Konráde, ani když je zadeklované :-) ... (Mimochodem, z termodynamického hlediska patří akvárium mezi tzv. otevřené systémy - výměna energií a částic s okolím. Ale to sem nepatří.) _____2) jak již bylo řečeno, jedna ze složek uhličitanového systému (jmenovitě kyselina uhličitá) je extrémně nestálá a velmi ráda se rozpadá na plynný oxid uhličitý a vodu, přičemž oxid uhličitý nám ze systému utíká ... tudíž v akváriu celkový anorganický uhlík konstantní nezůstává. _____Je mi líto lidičky ... prostě ... smiřte se s tím, že tento krásný, dokonale symetrický graf ... zmíněný snad v každém článku o CO2 v akváriu ... pro akvárium neplatí. https://www.youtube.com _____V akváriu není koncentrace volného CO2 určena pouze hodnotou pH (resp. Henderson-Hasselbalchovou rovnicí), ale navíc (dle Henryho zákona) i parciálním tlakem CO2 nad hladinou. _____Vysvětlení pro malý haranty : Uvědomte si, že hodnota pH pouze určuje poměry jednotlivých složek pufru - a naopak (viz HHR). Pokud je tím pufrem uhličitanový systém, jehož jedna složka se rozpadá na vodu a plyn, tak ten plyn prostě a jednoduše uteče. Hodnota pH ho v té vodě neudrží. Nemá jak. To je jen taková hloupoučká představa některých takychemiků, kteří ve své nevědomosti šíří podobné bludy po internetu. Nic víc. Oxoniové kationty H3O+ (nositelé kyselosti) nemají žádné kouzelné ručičky, aby oxid uhličitý chytly, držely a nepustily. Kapišto? |
||
|
■ pro připomenutí : |
||
|
_____Henderson-Hasselbalchova
rovnice (HHR) je celkem jednoduchý vztah mezi pH, pKA
(disociační /rovnovážná/ konstanta kyseliny HA) a
rovnovážnými koncentracemi kyseliny HA a její konjugované zásady A-. Používá
se k výpočtu pH pufrů. |
|
[ A- ] |
[ HCO3- ] |
|||||||||
|
pH = pKA + log |
resp. |
pH = 6,35 + log |
|
|||||||
|
[ HA ] |
[ H2CO3 ] |
|||||||||
| 24 | 218 | 150 | 9 | 75 | 110 | 150 | 9 | 110 | 221/20 | 24 |
|
_____Vzhledem k tomu, že téměř veškerá H2CO3 existuje ve vodě jako molekulární CO2, můžeme považovat [ H2CO3 ] = [ CO2 ]. Pokud tedy (přesně) změříme pH a alkalitu [ HCO3- ], řešíme logaritmickou rovnici o jedné neznámé [ CO2 ]. _____Jak již bylo řečeno, HHR má tak trochu problém s akvárkem, resp. s uhličitanovým systémem ... přesněji řečeno s tím, že je to systém otevřený. HHR platí v akváriu vždy jen v daném konkrétním okamžiku ... a za hodinu už je zase všechno jinak, neb část CO2 mezitím vyšuměla ... (což znamená jiný poměr rovnovážných koncentrací a tím i jiné pH) ... |
||
_____Henryho zákon Množství plynu, rozpuštěné za dané teploty v kapalině, je přímo úměrné parciálnímu tlaku plynu nad kapalinou : c = α . pi _____kde c je koncentrace plynu v kapalině, α je absorpční koeficient (rozpustnost plynu závisí na teplotě, se zvyšující se teplotou rozpustnost klesá), pi je parciální tlak plynu nad kapalinou. Poznámka (ad parciální tlak): Každý plyn, tvořící vzduch, působí na hladinu vody svým vlastním (parciálním) tlakem. (Tlak vzduchu je součtem těchto parciálních tlaků). _____Dle Henryho zákona má být ve vodě (při normální teplotě a tlaku) rozpuštěno cca 0,5 mg/l CO2 (tzv. rovnovážná koncentrace). Při této koncentraci nastává tzv. dynamické rovnováha - množství molekul CO2, které (za jednotku času) opustí vodu, je stejné, jako množství molekul, které se vrátí. Mluvíme o nasyceném roztoku (nasycený roztok je takový roztok, který je v rovnováze s nerozpuštěným plynem nad roztokem). Platí, že pokud množství volného CO2 v akvárku zvýšíme, systém se snaží navrátit zpět do rovnovážného stavu. _____námitka:
Henryho zákon neplatí pro plyny, které reagují s kapalinou, v níž se
rozpouštějí. A CO2 s vodou reaguje. |
||
|
■ co to všechno znamená |
||
|
_____Tvrzení, že z výše uvedeného grafu, resp. z Henderson-Hasselbalchovy rovnice (a nebo z její tabulkové podoby) můžeme (po změření pH a alkality) určit množství volného CO2 v akváriu, je mýtus. _____1) Teď úplně pominu fakt, že (opravdu) přesně změřit pH je pro drtivou většinu akvaristů naprostá sci-fi. Ani tady nebudu rozebírat, že i nepřesnost v řádu jedné desetiny pH nám po dosazení do HHR dává úplně jiné výsledky ... _____2) Také zcela zanedbám fakt, že alkalita změřená v akvárku může být způsobená ledasčím (nejen hydrogenuhličitany) (zdroj další chyby) _____3) Co ale ignorovat nelze, je fakt, že v akváriu se množství volného CO2 neustále mění !!! Ať už zvýšíme množství volného CO2 (nad rovnovážnou koncentraci) jakýmkoliv způsobem (viz X) ... stejně nám z toho akvária uteče. Není síly, která by ho tam udržela ... (Pozor - tím neříkám, že navyšování CO2 nemá smysl - než uteče, tak je samozřejmě k dispozici rostlinám) ... |
||
|
|
||
|
_____(ad
X)
(tak trochu mimo téma) ZVÝŠENÍ VOLNÉHO CO2 - máme na výběr tyto 3 způsoby: _____HCl + HCO3- → Cl- + H2CO3 ... H2CO3 → CO2 + H2O _____Jen
tak pro zajímavost ... napadají mě minimálně 3 různé způsoby, jak
interpretovat reakci HCl
s HCO3- : _____Jednorázová
akce, s krátkým efektem, navíc nebezpečná z hlediska stability pH
v nádrži. Prostě, snížit si pH v akvárku (na chvilku - než vyprchá CO2),
změřit alkalitu a dopočítat si z HHR (nebo z tabulky)
_____2) přidání hydrogenuhličitanů + okyselení vody ... jisté vylepšení předchozí verze (bez snížení KNK)
_____Samotný
přídavek HCO3- sice zvyšuje celkový
anorganický uhlík, volný CO2 však nikoliv ... ba právě naopak
(změní se poměr rovnovážných koncentrací, dojde ke zvýšení pH (viz
HHR) a snížení volného CO2 (viz graf). _____Stejně jako v prvním případě se jedná o jednorázovou akci (navýšený CO2 zase uteče). Nutno opakovat každý den (?) Tak trochu pakárna. _____3) sycení vody CO2 ... I tady se zvyšuje celkový anorganický uhlík. pH se ovšem snižuje (!). _____Výhoda: kontinuálnost → relativně konstantní množství CO2 v akváriu (když zanedbáme výkyvy během dne v důsledku fotosyntézy například). Když nepočítám (daleko přirozenější) ryby (viz níže), jde o bezkonkurenčně nejlepší způsob, jak v akváriu navýšit CO2 nad rovnovážnou koncentraci. _____Poznámka: Vzhledem k tomu, že (přirozený) úbytek CO2 je průběžně kompenzován ... vzniká do jisté míry "stabilní" prostředí (přibližně konstantní hodnota pH, přibližně konstantní množství volného CO2, přibližně konstantní poměr rovnovážných koncentrací uhličitanového systému). ... Díky tomu lze (se zavřením jednoho oka a s přimhouřením druhého :o) mrknout do Tillmansovy tabulky (ovšem při plném vědomí toho, že skutečné množství CO2 v akváriu bude menší). (viz problematika měření alkality a další chyby). |
||
|
■ aby to nebylo tak jednoduché :-) ... |
||
|
_____Kromě výše zmíněného, množství CO2 v akváriu permanentně (a nezanedbatelně) ovlivňují také ŽIVÉ ORGANISMY. A to směrem nahoru i dolů. Například rostliny dokáží v hustě zarostlé nádrži při fotosyntéze spotřebovat veškerý volný oxid uhličitý. Hodnota pH pak může díky posunutí uhličitanové rovnováhy vystoupat až na 8,5. (Při vyčerpání zásoby hydrogenuhličitanů dokonce i nad 10 - neslučitelné se životem). Podceňovat nelze ani bakterie (viz například níže zmíněná nitrifikace). volný CO2 v akváriu zvyšují : _____1) ryby (respirace) To asi vědí všichni :o) (kdo ne, ten by měl zlískat svého učitele biologie :o). Z osobní zkušenosti, pokaždé, když jsem udělal z normálního akvárka s rybama krevetkárium (nejdřív ve 150 litrech, poté i ve 450), bylo to na rostlinách setsakra znát. Výrazně se zpomalil růst, listy byly o dost menší (ale hustší). Zkrátka, kdo chce pěkně zarostlé akvárko a přitom nechce céóčkovat, musí mít v akvárku nějaké rozumné množství ryb. Zapsáno chemickou rovnicí : C6H12O6 + 6O2 → 6CO2 + 6H2O + energie (dýchání = aerobní biologický rozklad). _____2) rostliny (respirace, disimilace) Ano, pro někoho možná překvapení, ale i rostliny dýchají :-)(a nejen v noci :-). Je zvláštní, kolik lidí tohle neví. Mají prostě (od základní školy?) zafixováno, že rostliny spotřebovávají CO2 a vyrábějí kyslík, zatímco my spotřebováváme kyslík a vydechujeme CO2. I rostlinná buňka však musí dýchat (tj. oxidovat org. látky /cukry/ a získávat z nich energii "uskladněnou" při fotosyntéze). _____3) aerobní bakterie oxidace Fe2+, S2- nebo NH4+ (tzv. nitrifikace: NH4+ + 2O2 → NO3- + H2O + 2H+) (snížení pH → zvýšení CO2) _____4) anaerobní bakterie (methanogeneze, anaerobní biologický rozklad) C6H12O6 → 3CH4 + 3CO2 + energie volný CO2 v akváriu snižují : _____rostliny (fotosyntéza, asimilace) spotřeba CO2 při fotosyntéze je samozřejmě mnohem větší, než výdej CO2 při dýchání rostlin. Jak již bylo řečeno, rostliny dokáží při fotosyntéze kompletně zrušit veškerý volný CO2 v nádrži : 6CO2 + 6H2O + energie → C6H12O6 + 6O2
|
||
|
■ závěr |
||
|
|
_____Tenhle graf (i Tillmansova tabulka) jsou při určování množství volného CO2 v akváriu ... na prd. Sorry. (něco pro zlepšení nálady :-) ... |
|
| [1] J.Klikorka, B.Hájek, J.Votinský : Obecná a anorganická chemie, SNTL - učebnice pro VŠCHT, Praha 1989, 2.vydání | ||
| [2] Rolf Karlíček a kol. : Analytická chemie pro farmaceuty, Karolinum, Praha 1997 (dotisk) | ||
| [3] Slavomil Hejný a kol. : Rostliny vod a pobřeží, East West Publishing Company, Praha 2000 | ||
| [4] P.Hartman, I.Přikryl, E.Štědronský : Hydrobiologie, Informatorium, Praha 1998, 2. vydání | ||
| [5] http://www.pivokonsky.wz.cz/Hydrochemie13-14/Hydrochemie6.pdf | ||
| [6] http://www.wikiskripta.eu/index.php/Henryho_z%C3%A1kon | ||
| [7] http://rybicky.net/clanky/656-oxid-uhlicity-formy-distribuce-pridavani | ||
| [8] http://www.rybarstvi.eu/dok rybari/skripta.pdf | ||
| [9] http://web2.mendelu.cz/af_291_projekty2/vseo/print.php?page=3179&typ=html (zdroj obrázku) | ||
|
[ zpět na začátek ] |
||
| 24 | 1052/20 | 24 |
|
| ÚVOD | MOJE AKVÁRKA | LITERATURA | ODKAZY | ČLÁNKY | ATLASY | PORADNA | KNIHA NÁVŠTĚV | RŮZNÉ | NOVINKY | |
30 | |
|
| MAPA STRÁNEK | O WEBU | HOME | poslední aktualizace (této konkrétní stránky) : 16.11.2021 | |
30 | |
| 1052/20 + 2x24 | 20 | |